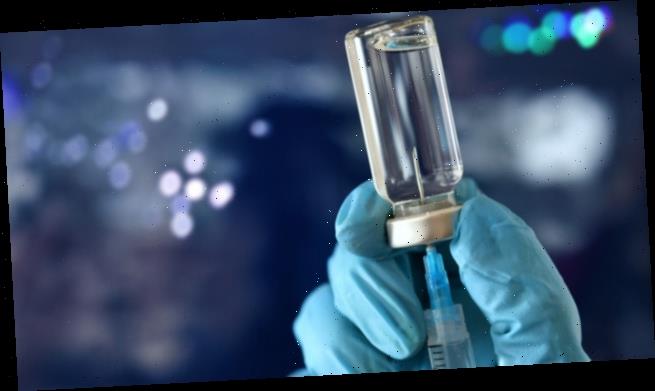
Für die Auffrischung des Corona-Impfschutzes kommen vor allem mRNA-Vakzinen zum Einsatz. Mit Bimervax® ist nun ein weiterer rekombinanter Proteinimpfstoff zugelassen worden. Die Zulassungsstudie legt nahe, dass dieser etwas besser gegen die SARS-CoV-2-Varianten Beta und Omikron schützen könnte als eine Auffrischung mit Comirnaty.
Zugegeben, Vakzinen zur Auffrischung des Impfschutzes gegen eine COVID-19 Infektion, dürften in vielen Apotheken derzeit nicht gerade höchste Priorität haben. Dennoch gibt es nach wie vor Patient:innen, die von einer (weiteren) Auffrischimpfung profitieren könnten. So liegt der Anteil der mindestens 60-Jährigen, die die für sie empfohlene zweite Auffrischung erhalten haben, laut Robert Koch Institut auf niedrigem Niveau. Für bestimmte Patient:innengruppen, wie etwa Hochbetagte, Altenheimbewohner:innen und Immundefiziente, kann zudem eine fünfte Impfung durchaus sinnvoll sein.
Für die Auffrischung steht nun eine weitere Impfoption zur Verfügung: am 30. März 2023 sprach die Europäische Kommission auf Empfehlung des Ausschusses für Humanarzneimittel der Europäischen Arzneimittelagentur die Zulassung für Bimervax aus. Was kann dieser neue Impfstoff also?
Mehr zum Thema

Geplante Änderung der Allgemeinverfügung
Praxen und Apotheken müssen COVID-19-Impfzubehör künftig separat bestellen
SARS-CoV-2 Variante XBB.1.16
Arcturus – steht eine neue COVID-19-Welle in den Startlöchern?
3 Millionen Euro Förderung durch das BMWK
Forscher wollen mRNA-Impfungen zu Schluckimpfungen weiterentwickeln
Bei Bimervax (früher COVID-19 Vaccine HIPRA) des spanischen Unternehmens HIPRA Human Health S.L.U. handelt es sich um einen adjuvantierten, rekombinanten Proteinimpfstoff. Das Antigen stellt hierbei ein Fusionsprotein dar, welches Anteile des Spike-Proteins der SARS-CoV-2-Virusvarianten Alpha und Beta enthält. Der Impfstoff ist demzufolge bivalent. Zugelassen ist Bimervax für die Auffrischung des Impfschutzes bei Personen ab 16 Jahren, frühestens sechs Monate nach einer Impfung mit einem mRNA-Impfstoff.
Ergebnisse der Zulassungsstudie
Der Zulassung zugrunde liegt eine sogenannte Immunobridging-Studie (Immunbrücken-Studie), bei welcher die Immunantwort auf den neuen Impfstoff mit der Immunantwort auf einen bereits zugelassenen Impfstoff verglichen wird. Eingeschlossen waren 765 Erwachsene, die mit jeweils zwei Dosen Comirnaty® grundimmunisiert waren. Zur Auffrischung erhielten diese nun entweder eine dritte Dosis Comirnaty oder aber eine Dosis Bimervax.
Im Vergleich zu dem Comirnaty-Booster bildeten die Bimervax-Geboosterten zwar weniger Antikörper gegen den ursprünglichen (Wuhan-)Stamm, gegen die SARS-CoV-2-Varianten Beta und Omikron bildeten Bimervax-Geboosterte jedoch mehr Antikörper als Comirnaty-Geboosterte. Die Antikörpertiter in Bezug auf die Delta-Variante waren bei beiden Auffrischimpfungen vergleichbar.
Weiterhin lagen auch Daten zur Auffrischimpfung von elf Jugendlichen ab 16 Jahren vor, welche auf eine vergleichbare Impfwirkung wie bei Erwachsenen schließen ließen.
Als Nebenwirkungen wurden Schmerzen an der Injektionsstelle, Kopfschmerzen, Müdigkeit und Muskelschmerzen beobachtet, die nach wenigen Tagen verschwanden.

COVID-19-Impfstoff von Sanofi
Vidprevtyn beta: Booster-Zulassung für weiteren Protein-Untereinheiten-Impfstoff

Phase-3-Studie
Was kann der japanische Corona-Wirkstoff Ensitrelvir?

STIKO sagt weiterhin nein
Brauchen Schwangere eine zweite Auffrischimpfung gegen Corona?
Bimervax ist nach Nuvaxovid® und Vidprevtyn® Beta der dritte aktuell zugelassene proteinbasierte COVID-19-Impfstoff, mit dem wesentlichen Unterschied, dass Bimervax ein bivalenter Impfstoff ist. Nuvaxovid ist nebst zur Auffrischung (ab 18 Jahren) auch zur Grundimmunisierung ab 12 Jahren zugelassen, Vidprevtyn® Beta als Booster ab 18 Jahren.
Quelle: Den ganzen Artikel lesen