Die wachsenden Kenntnisse über Krebs-Biologie hat sich verstärkt der Entwicklung von therapeutischen Strategien, die beinhalten das selektive targeting und töten Krebszellen. Eine solche therapeutische option ist die Bor-Neutronen-Einfang-Therapie (BNCT), eine Strahlentherapie Prozess mit der übertragung von Bor in Krebszellen und setzen Sie es auf Neutronen-Teilchen, wodurch es zu Unterziehen Kernspaltung, die tötet die Krebszellen. Wenn die ärzte können sicherstellen, dass Bor ist derzeit nur in Krebszellen, Sie können gezielt nur Krebszellen zerstören, ohne Schädigung der normalen Zellen des Körpers.
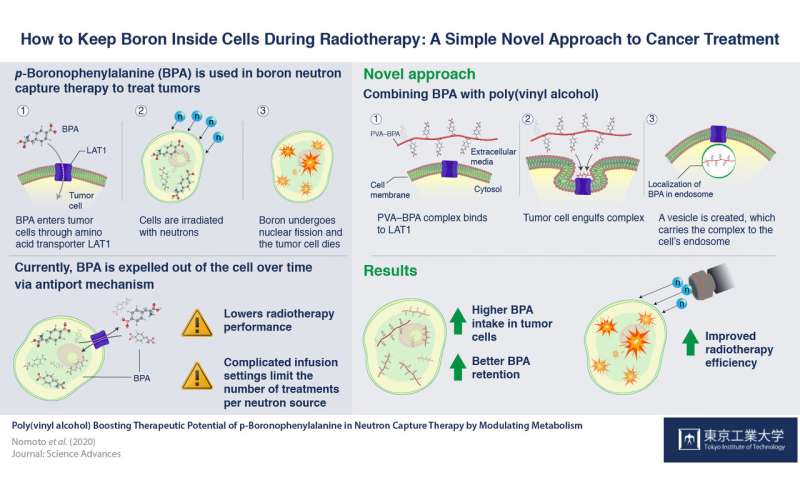
Wissenschaftler an der Tokyo Tech, der Universität Kyoto und Innovation Center der Nanomedizin (iCONM) haben sich verbessert, auf aktuellen BNCT durch die Kombination von BPA mit polyvinyl-Alkohol, zum herstellen der PVA-BPA-Komplexes, die eine längere Zell-retention-Zeit, die Verbesserung der Krebs-Tötung-Potenzial der BNCT.
Wissenschaftler zum ersten mal entdeckt die Art und Weise zu induzieren, um diese selektive Aufnahme mit p-boronophenylalanine (BPA). BPA ist eine Bor-enthaltende Verbindung mit einer Phenylalanin-Struktur. Einer der Faktoren, unterscheidet Krebszellen von normalen Zellen ein überangebot an speziellen Strukturen genannt LAT1 Aminosäure-Transporter, die erkennen, und ermöglichen den transport von Phenylalanin in der Zelle. Also, wenn BPA vorhanden ist, außerhalb von Krebszellen, die diese Transporter an der Oberfläche der Zelle erlauben, es zu betreten Krebszellen, wodurch erfolgreiche BNCT. BPA gilt seit langem als das beste Medikament für die BNCT.
Allerdings BPA hat einen Nachteil: Sobald BPA-Spiegel erhöhen, die innerhalb der Krebs-Zellen, es ist vertrieben, zurück über eine „antiport“ – Mechanismus, so dass es schwierig für die BNCT, um wirksam zu sein in einigen Fällen. So, die Patienten sind erforderlich, um zu erhalten eine kontinuierliche infusion von BPA für 30 bis 60 Minuten aufrecht zu erhalten, die notwendige Menge in den Zellen für die Reaktion, um erfolgreich zu sein. Diese lässt auch die Tür offen für menschliche Fehler, wie zum Beispiel der Möglichkeit, verdrängen die Nadel während des Prozesses.
, Diese Nachteile zu überwinden, haben Wissenschaftler an der Tokyo Tech, der Universität Kyoto und iCONM der Leitung von Prof. Nobuhiro Nishiyama beschlossen, zu erforschen anderen Mitteln Bindung von Bor innerhalb der Krebs-Zellen für längere Zeiträume. „Wir gingen davon aus,“ Prof. Nishiyama sagt, „dass die Modulation der Präsenz von BPA innerhalb der Zelle sicherzustellen, dass Sie nicht gesendet zurück über Ihre antiport-Mechanismus.“
Um dies zu untersuchen, mischten Sie eine Substanz namens polyvinyl-Alkohol (PVA) und BPA zusammen in form einer PVA-BPA-Komplexes, und beobachtete die Internalisierung dieser Verbindung in Krebs Zellen. Sie fanden, dass die Zugabe von PVA nicht auf die Phenylalanin-Struktur von BPA, so dass die LAT1-Transporter zu erkennen, die PVA-BPA-Komplexes. Jedoch, wie dieser Komplex wurde zu groß, um passieren die Transporter, die LAT1-Transporter statt verschlungen Komplex in Organellen genannt endosomen und transportiert Sie in die Zellen. Da BPA war jetzt sicher, sich in endosomen, die Krebs Zelle war nicht in der Lage, schieben Sie es sofort von der antiport-Mechanismus. Dies sorgte dafür, dass Bor bleibt in den Zellen für eine lange genug Zeit für die Krebszellen effektiv getötet. Diese Methode wurde auch getestet in Tiermodellen, und anti-Krebs-Aktivitäten der BNCT gefunden wurden, verbessert werden.
Neben der PVA stellt somit eine extrem einfache Lösung zur Erhöhung der therapeutischen potential von BPA. „Diese Technik ist mühelos“, sagt Prof. Nishiyama, „und bietet einen neuen Ansatz für drug delivery mit Fokus auf die metabolische elimination Prozesse von Drogen. Wir werden die Forschung auf der PVA-BPA-Komplexes für klinische Studien in Zusammenarbeit mit STELLA PHARMA-Unternehmen, durchgeführt hat BPA klinischen Studien.“
